ملخص الدرس / الثآنية ثانوي/فيزياء/الإنسان والبيئة /الكیمیاء في الحیاة الیومیة
الملخص
من الأستاذ(ة) لعاج إلياسالمواد الاستهلاكية ذات المصدر الطبيعي
مصادر الانواع الكيميائية :
يوجد نوعان من الانواع الكيميائية :
1- الانواع الكيميائية ذات المصدر الطبيعي : توجد في المنتجات الطبيعية (نباتات - حيوانات ثروات طبيعية ......)
- السكر : يتكون من النوع الكيميائي السكاروز
- القماش : يحضر من الصوف
يتدخل الانسان لعزل النوع الكيميائي المنتج طبيعيا أو تحويلها الى مواد أخرى .
2- الأنواعر الكيميائية ذات المصدر الاصطناعي : تحضر ابتداءا من مواد طبيعية أساسا
- الجزيئات المطابقة للأصل
- الجزيئات المصنعة
المركبات العضوية
- يعطي حرق جسم عضوي جسما صلبا هو الفحم : الفحم
- يعطي الإحتلااق الغبير التام جسما صلبا هو الفحم و سائل متكاثف هو الماء
- يعطي تفاعل الإحتراق التامغاز ثنائي أكسيد الكربون و سائل متكاثف هو الماء
- المركبات العضوية هي أنوا كيميائية تتألف جزيئاتها من عنصر الكربون و الهيدروجين و الأكسجين بالإضافة الى عناصر أخري
الفحوم الهدروجينية
الفحوم الهيدروجينية هي مركبات عضوية تتألف جزيئاتها من عنصري الفحم و الهيدروجين فقط صيغتها العامة من الشكل حيث يمثل x عدد ذرات الكربون فب الجزيء و يمثل y عدد الهيدروجين في الجزيء مصدر الفحوم الهيدروجين في الجزيء مصدر الفحوم الهيدروجينية هو البترول و الغاز الطبيعي
- عملية التقطير المجزأ للبترول :
البترول هو خليط لعدد كبير من المركبات العضوية منها غازية سائلة صلبة
إن الطريقة الأساسية لتكرير البترول هو التقطير بالتجزئة في أمدة ذات طوابق كما يوضح الشكل
- يسخن البترول الخام الى 370° C فتتجه الأبخرة المتشكلة صعود الطوابق حيث تتناقص درجة الحرارة كلما اتجهنا صعودا مرور بالطوابق حيث تتناقص درجة الحرارة كلما اتجهنا صعودا نحو الطوابق العليا
نحصل على المشتقات في الطوابق العليا البوتان والبروبان المستعملين كوقود للتدفئه وتاتي بعد ذلك في الطبقات السفليه من اجل درجات حراره عاليه المشتقات الثقيله المازوت الزيوت شمع البرافين الاسفلت....
الفحوم الهيدروجينيه المشبعه
ا- الالكانات
هي فحوم هيدروجينيه مشبعه تتضمن روابط تكافؤيه بسيطه صيغتها من الشكل
تسميه الالكانات
الاسم الأكان يتالف من جزئين
الجزء الاول
يعبر عن عدد ذرات الكربون في الجزيء
| 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | عدد ذرات الفحم |
| ديكـ | نونـ | اوكتـ | هبتـ | هكسـ | بنتـ | بوتـ | بروبـ | إيثـ | ميثـ | بداية الإسم |
الجزء الثاني
اللاحقه( ان ) التي تعبر عن الانتماء الى عائله الألكان
| الصيغة المجملة | الألكان | الصيغة المجملة | الألكان |
| هكسان | ميثان | ||
| هبتان | إيثان | ||
| أكتان | بوبان | ||
| نونان | بوتان | ||
| ديكان | بنتان |
أ- الالكانات
هي فحوم هيدروجينيه غير مشبعة صيغتها من الشكل تتميز هذه الفحوم بوجود رابطه مضاعفه على الاقل
تسميه الالكانات
يشتق اسم الاركان من اسم الالكان الموافق له استبدال اللاحقه (ان ) ب( ن )
| 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | عدد ذرات الفحم |
| ديكن | نونن | أوكتن | هبتن | هكسن | بنتن | بوتن | بروبن | إيثن | إسم الألكن |
أ- الالكينات
هي فحوم هيدروجينيه غير مشبعه صيغتها من الشكل تتميز بوجود رابطه ثلاثية
تسميه الالكينات
يشتق اسم الألكين من اسم الالكان الموافق له استبدال اللاحقه (ان) ب (ين)
| 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | عدد ذرات الفحم |
| ديكين | نونين | أوكتين | هبتين | هكسين | بمتين | بوتين | بروبين | إيثين | إسم الألكين |
احتراق الفحوم الهيدروجينيه
تتفاعل الفحوم الهيدروجينيه علي شكل
أ- الاحتراق التام
الاحتراق التام للفحوم الهيدروجينيه مع الهواء ينتج عنه غاز ثنائي اكسيد الكربون والماء مع انتشار حراره بفعل تحويل حراري
هي الطاقه المحوله حراريه عنداحتراق 1 مول من الميثان
ب- الاحتراق الغير التام
عندما تكون كميه الاكسجين غير كافيه لحدوث الاحتراق غاز احادي اكسيد الكربون و الفحم
والماء
الكيمياء التركيبية
منذ وجد الانسان على سطح الارض وهو يحاول استغلال كل ما عليها وتسخيره اياها لخدمته فقد استغل المواد الطبيعيه في التغذية اوفى التداوي بها كما استخدامها في زينته وفي نظافه الجسم مع تقدم العلم اصبح بالامكان تركيب كل المواد التي يحتاج اليها.
نشاط 1: صناعة معطر الموز
إن معطر الموز مادة عضوية (أستر ) له نكهة خاصة مثل التي نجدها في فاكهة الموز و يستخدم كمادة عطرية تضاف الر المشروبات , الحلويات .....و هو مركب أساسا من حلات الإيزوأميل يمكن تحضيره في المخبر من تفاعل كحول الإيزوأميل مع حمض الخل
أو
معطر الموز حمض كحول
1- المواد اللازمة :
5ملل من حمض الخل (الايثانويك ) 5 ملل من كحول الايوأميل حمض الكبريت المركز محلول مائي مشبع لكلور الصوديوم NaCl
2- المواد اللازمة :
سخان كهربائي حمام مائي 90°C حبابة الإبانة أنبوب اختبار وعاء زجاجي
ملاحظة هامة : يجب اتخاذ كل اجراءات السلامة المتبعة في المخبر أثناء التعامل مع المواد الكيميائية الخطرة (استعمال القفازات , النظارات , العمل تحت المدخنة )
3- خطوات العمل :
1-يوع في أنبوب اختبار 5 ملل من حمض الخل مع 5 ملل من كحول الايزوأميل و بعض قطرات من حمض الكبريت المركز (لتسريع التفاعل )
- تجهز أنبوبة الاختبار بأنبوب زجاجي طويل يعتبر كمبرد هوائي
2- نقوم بوضع أنبوبة الاختبار التي تحوي المزيج التفاعلي في حمام مائي 90° C لمدة 15 دقيقة كما يوضح الشكل 1
3- بعد أن يبرد الأنبوب يفرغ نحتواه في وعاء زجاجي به محلول مشبع لكلور الصوديوم (لأن كل مكونات المزيد تنحل في الماء المالح ما عدا خلات الإيزوأميل )
4- يفرغ بعد ذلك محتوى الوعاء الزجاجي في حبابة الإبانة ثم يرج و يترك لمدة بعدها نلاحظ تنشكل طورين غير متمازجين
- نستخلص السائل العائم الذي يمثل معطر الموز الصناعي و ذلك بفتح صنبور حبابة الإبانة كما يوضح الشكل 2
فنكون بهذا قد تحصلنا على عطر الموز (خلات الايزواميل ) يعرف من رائحته المميزة (رتئحة الموز )
النشاط 2: صناعة الأسبرين :
الأسبرين هو حمض الأستيل سالسليك و هو من الادوية التي تستعمل لعلاج الصداع و آلالم الرأس و الحمى ...استعمل هذا الدواء منذ القدم و كان يستخرج من ورق نبات الصفصاف .
في عام 1899 توصل "فلكس هوفمان " الى تركيب الأسبرين في المخبر من تفاعل حمض السالسيليك مع بلا ماء الخل وفق التفاعل التالي :
اسبرين حمض الساليسيليك
1- المواد اللازمة :
حمض الساليسيليك بلا ماء الخل حمض الكبريت المركز ماء مقطر حوجلة جافة ميزان
ملاحظة : بالماء الخل مركب خطير يتفاعل من الماء بشدة يجب التعامل معه بحذر
2- طوات العمل :
1- نقوم بوزن 5 عرام من حمض السالسيليك ونقوم بادخالها في حوجلة جافة .
2- نقوم بأخذ 6ملل من بلاماء الخل بواسطة مخار مدرج ( يتم ذلك تحت المدخنة بحذر )
3- نقوم بإضافة قطرات من حمض الكبريت المركز و نسخن المزيج في حمام مااري 50° C الشكل 3
4- ننتظر حوالي 10دقائق ثم نظيف الماء المقطر من أعلى المبرد
- نقوم بنزع المبرد الهوائي و نقوم بوضع الحوجلة داخل المدخنة و نضيف اليها بهدوء و كمية من الماء البارد بجرعات مع الرج
5- مضع الحوجلة داخل ماء بارد و جليد فنلاحظ بداية تشكل بلزرات أثماء التبريد و هي بلورات الآسبرين
6- نستخرج بلورات الاسبرين و نضعها في فرن لتجفيفها ثم نقوم بعصرها باستعمال ورق ترشيح فنحصل اخيرا على بلورات الاسبرين
نشاط 3 : استخلاص عطر الخزامى :
ما هو الخزامى ؟
الخزامى نبات عطري و كطبي ذو أزهار بنفسجية تتميز برائحة قوية تغرس للزينة و لاستخراج العطور منها و لها فوا ئد طبية كذلك و قد كانت مستعملة منذ القدم فكان الرومان يعطرون بها حماماتهم يمكن لنا استخلاص عطر الخزامى من زهورها و نستخدم في ذلك تقنية التقطير المائي
المواد - الأدوات: زهور الخزامى - ماء مقطر - السيكلوهكسان - حجر الخفان - كلور لصوديوم - كربونات البوتاسيوم الجافة
طريقة العمل :
أ- عملية التقطير :
نقوم بتقطيع أوراق الخزامى و نأخذ منها 10 غرام منها و نضعها في دور للتسخين به ماء مقطر نسخن المزيد حتى الغليان نحصل بعملية التقطير على ما يسمى بالقطارة كما يوضح الشكل 4
ملاحظة : كثافة الماء المقطر تساوي 1 كثافة الزيت الأساسي للخزامى يساوي 0,89
ب- استخلاص الزيت من القطارة
ملاحظة : زيت الخزامى ينحل بقلة في المار و أقل منه في الماء المالح
- من أجل استخلاص زيت الخزامى نضيف السكلوهكسان لأن زيت الخزامى يذوب أثر في هذا المركب
- نضع المزيج في حبابة التركيدد كما يوضح الشكل 5 :
- نفصل بعدها الطور المائي عن العضوي
- نضيف للطور العضوي كربونات البوتاسيوم نرج المحلول و نتركه لمدة .
كربونات البوتاسيوم مادة مجففة تمتص ما تبقى من الماء
- نرشح المحلول فنحصل على الزيت الأساسي عن عطر الخزامى
نشاط 4: صناعة الصابون
1- مبدأ التحضير :
يحض الصابون بتسخين مادة دسمة بوجود محلول مركز من أساس قوي (الصود أو البوتاسيوم )
التفاعل تاما و سريع
2- الوسائل المستعملة
المواد :
زيت عباد الشمس (زيت المائدة ) - هيدروكسيد الصوديوم (محلول الصود ) - بعض حجارة الخفان - ماء مالح
الأدوات :
سخان كهربائي - حمتم مائي بارد - حوجلة - كاس بيشر
3- الخطوات العملية :
ندخل في حوجلة من محلول الصود المركز و
من زيت عباد الشمس و بعض ححجارة الخفقن
يسخن المزيج مدة 15 الى 20 دقيقة
نترك محتوى الحوجلة ليبرد عمد درجة الحرارة العادية ثم ينقل الى حمام مائي بارد
يسكب محتوى الحوجلة في محلول من ماء مالح فنلاحظ تشكل راسب صلب فوق المحلول
نرج الخليط ثم نتركه ليركد
نجري عملية ترشيح بسيطة فنتحصل على الصابون
الفصل اللوني الكروماتوغرافيا
الكروماتوغرافيا :
هي طريقة أخرى للفصل بين مكونات خلسط و تعتمد على خاصية فيزيائية هي سرعة انتشار جزيئات الخليط التي تنتقل بفعل الخاصية الشعرية
الكروماتوعرافيا على الطبقة الرقيقة m , C, C
أ- وصف الطبقة الرقيقة :
- الطور الثابت :
عبارة عن لوح من الألمنيوم أو الزجاج أو البلاستيك مطلية بمادة هلامية مثل السيليس الهلامي
- الطور المتحرك :
سائل مذيب لمكونات الخليط عندما ينتقل يسحب معه مكونات الموضوعة على اللوح
ب- التقنية :
نقوم برسم خط رقيق جدا على اللوح الكروماتوغرافي المطلي بالطور الثابت يعرف هذا الخط بخط الإيداع الذي توضع عليه العينات التي يراد فصلها .
- نقوم بوضع اللوح داخل حوض مغلق بإحكام يحتوي على المذيب . (الشكل 1)
عند الوصول الى بعد 1 سم من الحافة العليا تتوقف العملية
- نعين الارتفاعات h المقطوعة من طرف كل كيميائي
النسبة بين المسافة التي قطعها النوع الكيميائي و المسافة التي قطعها الذيب تدعى " النسبة الجبهية " يرمز لها حيث
هذه النسبة تتعلق بالنوع الكيميائي و المذيب . (الشكل 2 )
ملاحظة :
في نفس الشروط التجريبية يكون لنوعين كيميائيين نفس النسبة الجبهية
المحاليل pH
1- وضعية - اشكالية :
تذوق بعض المحاليل المائية :
ماء معدني , عصير الليمون , الخل , الحليب , ماء مالح
أيها أكثر حموضة ؟ حاول أن ترتبها حسب الحموضة المتزايدة
2- سلم التمييز بين حمضية المحاليل :
2 -1 التجربة 1:
نبلل 3 قطع من ورق عباد الشمس بالمحاليل التالية :
- محلول ماء الجير
- ماء مقطر
- عصير الليمون
-المشاهدة :
- ماء الجير يلون الورق باللون الاأحمر
- ماء مقؤ يلون الورق باللون البنفسجي
2-2 تجربة 2:
نضيف قطرات من كاشف ملون يدعى أزرق البروموتيمول الى المحاليل التالية : (الشكل 1)
2- 3 تجربة 3:
نبلل 3 قط من روق الـ pH بالمحاليل التالية :
- محلول ماء الجير
- ماء مقطر
- عصير الليموون
- المشاهدة :
- ماء الجير يلون الورق باللون الاخضر
- ماء مقطر يلون الورق باللون الأصفر
- عصير الليمون يلون الورق باللون الأحمر
بالاستعانة بعلبة ورق الـ pH . عين قيم pH المحاليل السابقة .
- محلول ماء الجير : pH =11
- ماء مقطر : pH=7
- عصير الليمون : pH =2
نتيجة :
يمكن تصنيف المحاليل المائية باستعمال كواشف ملون أو ورق عباد الشمس أو ورق الـ pH الى :
- محاليل حمضية : pH<7
- محاليل معتدلة : pH=7
- محاليل أساسية : pH>7
3- اختبار و تصنيف المحاليل المائية :
3 -1 تجربة :
باستعمال ورق الـ pH رتب المياه و المحاليل المائية التالية حسب تزايد حموضتها
- ماء معدني غير غازي ماء معدني ماء الحنفية
ماء مالح , ماء الجير , ماء جافيل . عصير الليمةن , الخل , الحليب ,
هل يتوافق مع الترتيب عن طريق الذوق ؟
3 -2 خلاصة :
الشكل (2)
ملاحظة :
يمكن قياس نباشرة قيمة pH محلول مقياس الـ pH
الاحتراق في الهواء
1- نظرو تاريخية حول الاحتراق :
1) يقول "جون راي " القرن السابع عشر في محاولة تفسيره لتشكيل الجير ناتح أكسدة المعدن "
فالجير ناتج باعتبار أن الهواء يرتبط بالجسم و شيئا فشيئا حتى يصل الى دق أجزائه , و هكذا يزداد وزنه من البداية حتى النهاية , و هندما يتشبع لا يمكنه الإستزادة أكثر من ذلك و لا داعي للتسخين لأنه لا يجدي .
2) في 1 نوفمبر 1772 قدم لافوازييه رسالة الى الأكاديمية العلمية جاء فيها :
لقد اكتشفت ا الكبريت عند اشتعالة يزداد وزنه بدل العكس , هذه الزيادة في الوزن ناجمة عن تثبيت الكبريت لكمية هائلة من الهواء أثناء الاحتراق و اعتقد أن الزيادة في الجير المعدني يعزى الى فس السبب .
3) في نوفمبر 1774 يقرا "لافوازييه " في الاكاديمية رسالة حول احتراق القصدير :
راينا ان جزءا من الهواء قادر على الالتصاق بنامواد المعدنية ليشكل الجير المعدني بينما الجزء الآخر يرفض المساهمة فيهذا التركيب . هذه الحادثة جعلتني أشك في ان الهواء كيان بسسيط و أنه يتشكل من مائعين هوائيي القوام و مختلفين . و العمل الذي اقوم به حول كلسنة (عملية التسخين يرافقه تحول في طبيعة الجسم )
الزئبق و استعادته من جيره أكد لي هذا الاعتقاد , و اظن انه يمكن لي التصريح بان الهواء ليس كله صالحا للتنفس , و إن الجزء الصالح فقط هو الذي يرتبط بالمعادن أثماء كلسنتها و إن ما يتبقى بعد هذه العملية ما هو الا الجزء الطالح غير القادر على مواصلة تنفس الحيوانات و على اذكاء اشتعال الأجزاء
الاأسئلة :
1- على ماطا تتكلم النصوص ؟
2- هناك تطور اريخي لمفهوم الاحتراق , اشرح هذا التطور ؟
3- مالرأي الذي توصل اليه لافوازييه " حول دور الهواء في الاحتراق ؟
الإجابة :
تتكلم هذه المقتطفات عن ظاهرة الاحتراق في الهواء , ان مفهوم الاحتراق السائد في ذلك العهد هو تثبيت الهواء في الجسم المحترق ( تمت التجارب على الكبريت و القصدير و الزئبق للحصول على جير المعدن ) و أنه من جراء هذا التثبيت يزداد وزنها . و ان عملية التثبيت مقتصرة على جزء فقط من الهواء الجوي ( الحد الذي يحدث فيه التشبع و يتوقف عند الاحتراق - الكلسنة - ) و لكن مع لافوازييه تمت مراجعة الفكرة و استطاع أن يبيتن أن " الجزء المثبت " يختلف عن "الجزء المتبقي" و كلا الجزئين عبارة عن غاز يشبه الهواء في مظهره لكن يختلف في طبيعته . و لكن بعد تجارب اخرى استطاع ان يؤكد أم جزء " المثبت " "و يقصد به المتفاعل " هو الغاز المعروف بـ " ثائي الأكسجين " الذي يساعد على التنفس . أما الجزء غير المثبت هو غاز " ثنائي الأزوت "
تمكن لافوازييه من خلال هذه البحوث أن يصل في النهائية الى ان الهواء ليس جسما بسيطا , بل جسم خليط " وحدة تركيب الهواء الذي قريب من التركيب الحالي للهواء الجوي
2- احتراق شمعة :
تجربة 1 :
ضع شمعة مشتعلة داخل ناقوس به هواء
المشاهدة :
الشمعة تبقى مشتعلة لمدة ثم تنطفئ
التفسير :
في الهواء يوجد غاز يساعد على الاشتعال ثم ثنائي الاكسجين . كميته داخل الناقوس محدودة عند استهلاكها أثناء الاحتراق تنطفئ الشمعة . (الشكل 1)
تجربة 2:
ضع شمعة مشتعلة في حوض به ماء و نكس الناقوس فوق الشمعة (الشكل 2)
مشاهدة :
- انطفاء الشمعة بعد مدة
- صعود الماء في الناقوس الى مستوى معين
التفسير :
صعود الماء في الناقوس الى مستوى معوضا ثنائي الأكسجين المستهلك في الاحتراق و التي كميته محدودة داخل الناقوس (اذا كان الناقوس مدرجا يمكن التأكد \أن مستوى الماء يرتفع بمقدار خمس 1/ 5 الحجم الأصلي و الذي يؤكد أن حجم غاز ثنائي الأكسجين يشتغل تقريبا خمس حجم الهواء و أن الحجم المتبقي أربعة أخماس 4 /5 هو غاز ثنائي الأزوت و آثار لغازات أخرى
النتيجة :
الهواء جسم غازي مركب يتكون من غاز يساعد على احتراق الشمعة هو ثنائي الاكسجين و غاوات اخرى لا تساعد لى الاحتراق ( الناقوس لم ينتلئ بالماء )
تجربة 3:
1) نحقق التجربة التالية :
نستعمل شمعة (أو مصباح بنزن ) ماذا تشاهد على الجدران الداخلية للأنبوب ؟ أو استعمل هذه التجربة :
كبريتات النحاس الجافة (الشكل 3)
المشاهدة :
- تشكل قطرات من الماء على الجدران الداخلية للأنبوب
- أسكب كمية من رائق الكلس في الأنبوب
المشاهدة :
تعكر رائق الكلس
النتيجة :
الإحتراق هو تفاعل بين الشمعة (أو أي جسم ) و غاز ثنائي الأكسجين و ينتج عنه الماء (H2O) و غاز ثنائي أكسيد الفحم (CO2)
تجربة 4:
نحقق التجربة التالية : (الشكل 4)
المشاهدة :
- القارورة 1 : انطفاء الشمعة بعد مدة
- القارورة 2 : انطفاء الشمعة بعد مدة
- القارورة 3 : الشمعة تبقى مشتعلة
التفسير :
- القارورة 1: كمية غاز ثنائي الأكسجين محدودة داخل القارورة .
- القارورة 2 : الغاز الناتج عن الاحتراق هو CO2 يشغل الحيز داخل القارورة لأنه أثقل من الهواء و يمنع مواصلة الاحتراق
- القارورة 3: الفتحة الجانبية تسمح بدخول الهواء الى القارورة باستمرار .
النتيجة :
- تفاعل الاحتراق يتوفق على كمية غاز ثنائي الاكسجين .
- إذا كانت غاز ثنائي الأكسجين كافية فان الاحتراق يكون تاما , فيعطي غاز ثنائي أكسيد الكربون و بخار الماء .
-إذا كانت كمية غاز الأكسجين غير كافية ف‘ن الاحتراق يكون غير تاما فيعطي هباب الفحن C(دخان أسود ) و أول أكسيد الكربون (CO) و اللهب يكون أصفر
3- أكسدة المعادن :
تجربة 1 : احتراق المغنزيوم :
نعرض شريط من النغنزيوم Mg الى لهب مصباح بنزن
- كيف يكون التوهج ؟
- ما هو ناتج الاحتراق؟
المشاهدة :
- الاحتراق سريعا و ناشرا للحرارة و يصاحبه لهب ووميض .
- تشكل جسم صلب أبيض .
النتيجة :
عند احتراق المغنزيوم بغاز ثنائي الاكسجين فإنه يحدث استهلاك لغاز ثنائي الاكسجين و ينتج جسم صلب هو اكسيد المغنزيوم MgO
اذن يحدث في هذا التفاعل اكسدة المعدن
تجربة 2: اكسدة الحديد في الهواء الرطب :
نضع كمية من صوف الحديد في أنبوب به هواء رطب ( به كمية من الماء ) ماذا تلاحظ بعد عدة أيام ؟ (الشكل 6)
- المشاهدة :
يغطي صوف الحديد الموجود في انبوب الهواء الرطب بطبقة بنية بينما لا نشاهد ذلك في الانبوب الآخر
النتيجة :
- في الهواء الجاف لا يتأثر الحديد
- فب الهواء الرطب يتأثر الحديد بغاز ثنائي الاكسجين و بالرطوبة و يعطي صدأ الحديد ( يتكون اساسا من هيجروكسيد الحديد الثلاثي Fe (OH)2
- الصدأ لا يحمي المعدن من التآكل
- لحماية المعدن من التآكل يغطى بطبقة من الطلاء
الترسبات الكلسية
1- وضعية إشكالية :
يتغير مظهر الأواني المنزلية التي يسخن فيها الماء مع الوقت , حيث تظهر على جدرانها الداخلية ترسبات تشوه منظرها .
أثناء غسل الأواني أو الثياب ببعض أنواع المياه نجد صعوبة في استعمال الصابون حيث نحتاج الى إضافة كمية كبيرة منه .
فسر سبب ذلك ؟
2- اختبار باستعمال ماء الجير :
تجربة :
نضيف الى كل أنبوب محلول صابوني يتكون من (ماء مقطر + صابون )
- نقوم بعملية الرج
الشكل 1
3- عسر الماء :
3 -1 تجربة :
نضيف نفس الحجم من المحلول الصابوني الى محتوى الانابيب التالية :
ثم نقوم بعملي الرج :
الشكل 2
المشاهدة :
الأنبوب 1 : تشكيل رغوة كبيرة
الأنبوب 2: تشكيل رغوة
الانبوب 3 : تشكل رغوة
الانبوب 4 : ظهور راسب عدم تشكل رغوة
النتيجة :
الماء الذي لا يشكل رغوة مع الصابون و بعطي ترسبات كلسية يسمة الماء العسر (L'eau dure )
الماء قليل العسر يسمى ماء يسر أو ماء عذب .
التفسير :
عسر الماء يتعلق بتركيز شوارد الكالسيوم و شوارد المغنزيوم
-2 الدرجة الهيدروتيمترية :
للتعبير عن درجة عسر الماء نستعمل الدرجة الهيدروتيمترية .
الدرجة الهيدروتيمترية تكافئ 10mg من كربونات الكالسيوم في لتر واحد من الماء
أو 4mg من الشوارد
في واحد لتر من الماء
مثال :
قيمة محصورة بين 12 و 18؟ : الماء عسر .
( تركيز يكون محصور 120 و 180 mg/L )
الضغط الجوي
1- مفهوم الضغط الجوي :
تجربة 1:
اسحب الهواء الموجود في قارورة بلاستيكية (قارورة ماء معدني فارغة ) (الشكل 1)
المشاهدة :
تشوه شكلالقارورة
استنتاج :
الهواء يضغط بقوة على جوف القارورة
تجربة 2:
- املأ كأسا بالماء الى حافته
- قم بشده بورقة ثم اقلب الكأس رأسا على عقب
المشاهدة :
الورقة تبقى ملنصقة بالكأس حيث لا تسمح بخروج الماء
استنتاج :
- الهواء يؤثر على السطح الملامس له بقوة ضاغطة
- هذه القوة عمودية على السطح و موجهة من الهواء نحو السطح
- نقول أن للهواء ضغط يدعى الضغط الجوي
تجربة 3 :
1- ضع قارورة مفتوحة من الاعلى و من الاسفل فوق حوض من الماء
المشاهدة :
للماء نفس الارتفاع في القارورة و في الحوض
2- ثم اسحب منها جزء من الهواء ثم أغلق الصنبور
المشاهدة :
صعود الماء في القارورة و انخفاضه في الحوض
- قم بضخ الهواء في القارورة ثم أغلق القارورة
المشاهدة :
نقصان الماء في القارورة و ارتفاعه في الحوض
استنتاج :
للهواء الجوي ضغط يدعى الضغط الجوي , يؤثر على السطح الملامس له بقوة منحاها عمويا على السطح المضغوط
تجربة طورشلي (Torrcelli )
أ- التجربة :
قام بملأ الأنبوب طوله 1m بالزئبق و مكسه فوق حوض من الزئبق
- المشاهدة :
- ارتفاع الرئبق في الانبوب بمقدار 76Cm عندما تجرى التجربة على مستوى سطخ البحر
- عنداعادة التجربة في أماكن أعلى من سطخ البحر يقل ارتفاع الزئبق فب العمود (الشكل 3)
استنتاج :
- الضغط الجزي يؤثر على الزئبق في الحوض بقوة تجعل الزئبق يرتفع في الانبوب
- يقل الضغط الجوي كلما ارتفعنا عن سطح البحر
3- مقياس الضغط :
مقياس الضغط الجوي يسمى البارونتر و يوجد منه عدة أنواع
البارونتر الزئيقي
البارومتر المعدني
4- وحدة قياس الضغط الجوي :
الهواء الجوي يؤثر على الأجسام الملامسة له بقوة منحاها عموديا على السطح الملامس له
يرمز للضغط الجوي بـ
حيث :
الوحدة الدولية للضغط الجوي هي الباسكال (Pascal) و يرمز لها بـ Pa
مضاعفات الباسكال : الهيكتوباسكال (hPa)
1hPa=100Pa
وحدات أخرى للضغط الجوي
الكشف عن الماء
وضعية - اشكالية
الماء يوجد في الطبيعة بشكل مستقل كما يعتبر من المكونات الاساسيةلكثير من الاجسام حيث يكون ممزوجا بمواد أخرى و بالتالي تمييزه عن المواد الاخرى مباشرة بالعين المجردة أمر غير ممكن
اقترح طريقة عملية الكشف عن الماء في مختلف الأجسام محددا الوسائل اللازمة لذلك
تجربة 1: تحصسر الكاشف :
أ - الوسائل :
1- مصبتج بنزن
2- جفنة
3- مخلاط (قضيب زجاجي )
4- كبريتات النحاس المائية
الشكل (1)
ب- الخطةات العملية :
نضع كمية من كبريتات النحاس المائية ذات اللون الازرق في جفنه
نيحتها مع التحريك بالقضيب الزجاجي
المشاهدة :
تلون كبريتات النحاس الابيض التي تسمى عندئذ كبريتات النحا اللامائية ( الجافة )
الشكل (2)
ملاحظة : عند التسخين في انبوب اختبار نشاهد قطرات من الماء على الجدران الداخلية عند بداية التسخين
تجربة 2: اختبلر الكاشف :
نضع قطرة من الماء فوق كومة من كبريتات النحاس اللامائية
المشاهدة :
تغير لون كبريتات النحاس من الابيض الى الازرق
الشكل (3)
استنتاج : يمكن الكشف عن الماء بكبريتات النحاس اللامائية
تجرية 3: الكشف عن الماء في بعض السوائل:
نضع قطرة من كل سائل على كومة من كبريتات التحاس اللامائية
الشكل (4)
المشاهدة و الاستنتاج :
| هل السائل يحتوي على ماء ؟ | لون كبريتات النعاس اللامائية | السائل |
| نعم | أزرق | الحليب |
| لا | ابيض | زيت عباد الشمس |
| نعم | ازرق | عصير البرتقال |
| لا | ابيض | عطر |
تجربة 4: الكشف عن الماء في بعض المواد الصلبة:
1- نضع كمية من كبريتات النحاس الجافة فوق قطعة خيز ثم نقوم بتسخينها
2- نضع كمية من كبريتات النخاس الجافة فوق قطعة من حبة بطاكا
3- نمزج كمية من السكر مع كمية من كبريتات النحاس الجافة
4- نضع كمية من كبريتات النحاس الجافة قوق نصف تفاحة
المشاهدة و الاستنتاج :
| هل السائل يحتوي على ماء ؟ | لون كبريتات النحاس اللامائية | المادة |
| نعم | أزرق | قطعة حبز |
| نعم | أزرق | حبة بطاطا |
| لا | أبيض | سكر |
| نعم | ازرق | تفاح |
الماء الصالح للشرب
وضعية - اشكالية :
كلما احسست بالعطش أو احتجت الى طهي الطعام فإنك تتجه مباشرة الى فتح الحنفية فينزل ماء عذبا تأخذ ما تحتاج و في بعض الاحيان تترك الماء يضيع في المجاري
هل فكرت يوما كيف يصل هذا الماء الة الحنفية ؟
هل المياه الصافية التي تحصلنا عليها سابقا صالحة للشرب ؟
الاشارة الى كيفية الحصول على المياه الصالحة لشرب انطلاقا من مياه السدرد
1- طرق معالجة المياه :
مياه الانهار و السدود لا يمكن استهلاكها مباشرة لأنها تحتوي على مواد ضارة مثل : الرمل . الاتربة , مةاد كيميائية سامة , و أيضا بيكتيريا
تمر عملية المعالجة بعدة مراحل أهمها :
1- الغربلة بالشبكة (Tamisage ) : لفصل الاجسام ذات الحجم الكبير ( الاخشاب , القطع البلاستيكية ...)
2- الإبانة و الطفو ( décantation et Floculation ) : تترسب الأجسام الثقيلة (مثل الرمل ) و الخفيفة تطفو على السطح (اضافة مواد كييميائية مثل كلور الحديد و كبريتات الالمنيوم لتجميع الجزيئات الصغيرة لجعلها تطفو أو تترسب ) (مثل الدهون )
3- الترشيح عبر الرمل : لإزالة الشوائب الصغيرة العالقة .
4- الترشيح عبر الفحم النشط: لإزالة مسببات الرائحة و الطعم غير المرغوبين فيهما
5- التعقيم بالأوزون (stérilisation avec l'ozone ) : لإزالة الجراثيم (و كل الكائنات المجهرية الحية )
6- التعقيم بالكلور ( stérilisation avec du chlore ) أو بماء جافيل : لحفظ الماء أشناء مقله الى المستهلك في بعض الحالات تضاف بيكتيريا خاصة لإزالة بعض المواد العضوية ( في حوض التركيد )
المخطط المرفق يمثل مراحل المعالجة
2- المياه المعدنية الطبيعية :
المياه المعدنية الطبيعية (قد لا تخضع الى المعالجة الكيميائية أوالبيولوجية ) تستخرج إما بالتدفق الطبيعي أو بحفر الآبار
يتميز الماء المعدني عن الماء العادي بـ
-نسبة الأملاح المعدنية التي يحتويها
- تركيب ثابتمن الاملاح
- تراعي فيها شروط الحفظ و النقاوة المكروبيولوجية و التركيب الكيميائي قبل استغلالها
و أهم أنواعي :
- المياه المعدنية الطبيعية الغازية : تحتوي على غاز ثنائي أكسيد الفحم
- المياه المعدنية الطبيعية الغازية : تحتوي على غاز ثنائي أكسيد الفحم
- المياه المعدنية الطبيعية غير الغازية
- المياه المعدنية الطبيعية المغزاة (gazéifiée) : يضاف لها CO2
أذكر أسماء بعض المياه التي تباع تحت اسم ( مياه معدنية طبيعية )
ملاحظة : المياه العادية تسوق تحت اسم ماء المنبع
3- معايير الماء الصالح للشرب :
تخضع مياه الشرب دولية تحددها المنظمة العالمية للصحة (O.M.S) و عددها 62 معيار
أهم هذه المعايير :
- معايير اللون و الرائحة و الطعم و الشفافية
- معايير خاصة بالأجسام غير المرغوب فيها : لا تتجاوز معينا (.......-F; NO3)
- معايير خاصة بالمواد السامة : الكميات المسموح بها قليلة جدا (.......Pb, Hg , As)
- معايير ميكروبيولوجية : الميكروبات و الفيروسات
- معايير خاصة بالمبيدات
الماء النقي
وضعية - اشكالية
كيف ننقي الماء الصافي المتحصل عليه سابقا من الأجسام المنحلة فيه ؟
حدد الطريقة و الوسائل المستعملة .
1- عملية التقطير (distillation )
أ- الأدوات المستعملة :
1- مسخن كهربائي
2- ماء صافي
3- بالون
4- مبرد
5- فتحة دخول ماء بارد
6- فتحة خروج ماء ساخن
7- كأس بيشر
8- ماء مقطر
9- ترمومتر
ب- وصف التجربة :
- تسخين الماء الصافي حتى الغليان فيتحول الى بخار منطلقا عبر انبوب التبريد (المبرد )
- يتكثف بخار الماء في المبرد متحولا الى قطرات من الماء تنزل في الكأس
- في عملية التقطير يحدث فضل الاجسام المنحلة في الماء :
الأملاح تترسب في البالون بعد نهاية التسخين أما الغاوات تنطلق أثناء التسخين
ج- الماء النقي :
هو الماء الذي يتألف من نوع واحد من الجزيئات هي جزيئات الماء التي صيغتها H2O
د- بطاقة تعريف الماء النقي :
- الصيغة الجزيئية :H2O
يتألف جزيء الماء من ذرتين هيدروجين H و ذرة أكسجين O
- الحالة : يوجدفي ثلاثة حالات (صلبة , سائلة , غازية )
- المظهر : عديم اللون و الرائحة و الطعم
- بعض خصائصه :
مذيب جيد لكثير من الاجسام
ناقل ضعيف للكهرباء
الثوابت الفيزيائية : درجة حرارة التجمد : C °0
درجة حرارة التبخر : 100° C
الكتلة الحجمية :
خصائص الهواء
1- قابلية الهواء للإنظغاط و التمدد :
تجربة :
احجز كمية من الهواء في محقنة (la suringue ) دواء وشد فتحها بالأصبع (الشكل 1)
المشاهدة :
- المكبس ينتقل لمسافة قليلة (نقصان حجم الهواء المحتجز )
- المكتس يعود الى وضعه الابتدائي عند نركه حرا (الشكل 1)
المشاهدة :
- المكبس ينتقل لمسافة (زيادة حجم الهواء المحتجز )
- المكبس يعود الى وضعه الابتدائي عند تركه حرا
استنتاج :
عندما نقلل من حجم الهواء فإن ضغطه يزداد بالنسبة للضعط الجوي
- عندما نزيد في حجم الهواء فإنه يشتغل كل الحجم المتاح له و ضغطه يقل بالنسبة للضغط الجوي .
و منه الهواء غاز قابل للتمدد و الانضغاط (الهواء مرنا ) عندما نقلل حجما منه يزداد ضغطه و العكس صحيح و هذا عند درجة حرارة ثابتة .
- تستعمل هذه الخاصية في مجالات مختلفة كنفخ العجلات المطاطية (السيارات ....) مضخات دفع السوائل , دهن الأثاث ....
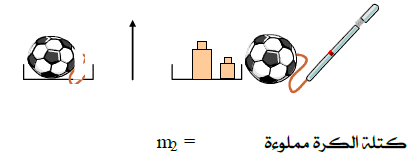
2- وزن الهواء :
تجربة :
1) خذ كرة (كرة قدم مثلا ) قيل ضخ الهواء فيها قم بوزنها (الشكل 3)
2) أضف الى الكرة كمية من الهواء (يحيث يبقى الحجم ثابتا ) ثم أعد وزنها من جديد . (الشكل 4)
المشاهدة:
الكتلة m2 أكبر من الكتلة m1
استنتاج :
للهواء كتلة مقدارها الفرق بين الكتلتين
3- كنلة واحد لتر من الهواء :
تجربة :
خذ الكرة السابقة المملوءة منها واحد لتر من الهواء باستعمال قارورة سعتها 1L مملوءة بالماء منكسة فوق حوض من الماء
(الشكل 5)
- أعد وزن الكرة من جديد (الشكل 6)
استنتاج :
كتلة 1 لتر من الهواء :
m=m2=m3=
- في الشرطين النظامييمن (1atm , 0°C) كتلة واحد لتر من الهواء تساوي 1,29 g
- الكتلة الحجمية للهواء 1,29 g/L
- الغازات التي لها كتلة حجمية أكبر من الهواء تبقى في الاسفل CO2 و التي لها أقل تصعد نحو الأعلى (غاز الهيليوم )
دورة الماء في الطبيعة
وضعية - اشكالية
هل كمية الماء في الطبيعة ثابتة ؟
- الحركة مستمرة للماء بين الارض و الغلاف الجوي تسمى دورة الماء في الطبيعة
- الماء يسري بصفة دائمة في الغلاف الجوي على سطح الارض و تحت سطح الارض تحت تأثير حرارة الشمس فإن مياه البحار الأنهار و البحيرات تسخن فتتخبر متحولة الى بخار الماء الذي يشكل السحب هذه الاخيرة تدفعها الرياح و عندما تعبر المناطق الباردة فإن بخار الماء يتكثف ليعود اقطا على سح الارض على شكل مطر أو ثلج أو برد
عندما يصل ماء المطر الى سطح الارض فإنه :
إما أن يتبخر من جديد الى الغلاف الجوي
أو يسري على سطح الأرض مغذيا المجاري الأنهار و الادوية التي تعيد جزء منه الى البحار
أو ينفذ تحت سطح الأرض مغذيا الطبقات المائية في باطن الارض و الذي يعود جزء منه الى سطح الأرض بعدة طرق
اذن يمكن تقسيم دورة الماء الى عدة مراحل :
التبخر : évaporation
التكاثف : condensation
التساقط : pécipitation
السيلان : ruissellement
النفوذ: infiltration
ماذا يوجد في المحلول المائي ؟
1- ماهي طبيعة مكونات المحلول المائي ؟
تجربة 1:
- نحقق تجربة التحليل الكهربائي المبينة في الشكل التالي :
- نضع في وعاء التحليل ماء نقي
- نغلق الدارة
( الشكل1 )
المشاهدة :
- عدم اشتعال المصباح
- عدم انحراف المؤشر للمقياس
تجربة 2:
- نضيف الى الماء النقي كمية من السكر فنتحصل على محلول مائي للسكر
- نغلق الدارة
المشاهدة : - عدم اشتغال المصباح
- عدم انحراف مؤشر المقياس
التجربة 3:
- نعيدالتجربة بإضافة كمية من كلور الصوديوم (ملح الطعام) الى الماء النقي نتحصل على محلول مائي للملح
- نغلق الدارة
(الشكل 2)
المشاهدة :
- اشتعال المصباح
- انحراف المؤشر
- النتيجة
- الماء النقي و المحلول الماء للسكر لا ينقلان التيار الكهربائي
- المحلةل المائي للملح ينقل التيار الكهربائي
التفسير :
- المسؤول عن نقل التيار في المحاليل هي الشوارد فالماء النقي يحتوي فقط جزيئات الماء H2O
المحلول المائي للسكر لا يحتوي على شوارد يحتوي فقط على جزيئات السكر
أما المحلول الملحي فيحتوي على شوارد الصوديوم+Na و شوارد الكلور -Cl بالاضافة الة جزيئات الماء
2- لماذا يعض المحاليل المائية لها لون ؟
تجربة :
- نحضر مجموعة من المحاليل في انابيب اختبار
- نستعمل كلور الصوديوم كبريتات النحاس برمنغنات البوتاسيوم بيكرومات البوتاسيوم
المشاهدة :
الانبوب 1: لونه بنفسجي
الانبوب 2: لونه برتقالي (أصفر برتقالي )
الانبوب 3 : لونه ازرق
الانبوب 4: عديم اللون (شفاف )
الشكل 3
النتيجة :
- المحلول الناتج له لون يتعلق بطبيعة الجسم المنحل فيه
التفسير :
- الشوارد هي المسؤولة عن لون المحلول
الانبوب 1: اللون بنفسجي يعود الى شوارد البرمنغنات
الانبوب 2: اللاون البرتقالي (أصفر برتقالي ) يعود الى شوارد البيكرومات
الانبوب 3: لونه أزرق يعود الى شوارد النحاس
الانبوب 4: عديم اللون (شفاف ) يحتوي على الشوارد و
ملاحظة:
توجد نوعان من الشوارد
الشوارد الموجبة مثل : و
الشوارد السالبة : مثل و
هل الماء يحتوي على غازات ؟
وضعية - اشكالية
الماء الطبيعي يحتوي على اجسام منحلة فيه هل البعض منها غازية ؟
تجربة 1:
نملأ انبوب اختبار عادي و نسده بورقة ترشيح ننكسه فوق حوض من نفس الماء يكون ساخنا قليلا (الشكل 1)
المشاهدة :
بعد مدة انطلاق فقاعات غازية من الحوض نحو الانبوب
استنتاج
الماء الطبيعي يحتوي على غاز (الهواء )
2- الماء المعدني الغازي :
تجربة 1: تحضير الكاشف رائق الكلس
(الشكل 2)
تجربة 2 : اختبار الكاشف
(الشكل 3)
تجربة 3: الكشف عن غاز ثنائي أكسيد الكربون في ماء معدني غازي
(الشكل 4)
المشاهدة :
تعكر رائق الكلس
النتيجة :
الماء المعدني الغازي يحتوي على غاز ثنائي أكسيد الكربون , يتعكر رائق الكلس وفق المعادلة الكيمائية :
بطاقة تعريف ثتائي أكسيد الكربون :
الصيغة الجزيئية : CO2
المظهر : غاز عديم اللون و الرائحة
حالة الفيزيائية : غاز في الشرطين العاديين من الضغط و درجة الحرارة
يوجد بحالة ثلج تحت ضغط عالي بستعمل لإطفاء الحرائق يعكر رائق الكلس (طريقة الكشف عنه )
يوجد في الهواء بنسبة قليلة ينحل في الماء
ضروري لعملية التمثيل الضوئي في النباتات ينتج عن الاحتراق التام للمحروقات
المسبب الرئيسي لظاهرة الاحتباس الحراري غير سام لكنه خانق
وجود و تنوع الهواء
1- مقدمة :
الغلاف الجوي الارضي مزيج غازي نسميه الهواء يحيط بالكرة الارضية بسمك يقارب 1000Km تاهواء ضروري لحياة الإنسان و الكائنات الحية على الأرض
2-أصل الغلاف الجوي :
- الغاوات الأولى في الغلاف الجوي هي الغازات المنطلقة من البراكين
- المزيج الغازي المكون للغلاف الجوي الحالي هو نتيجة عمليات و تحولات تعود الى 4,5 مليار نسمة
- الغلاف الجوي في البداية كان مؤلفا من الغاوات ثنائي أكسيد الكربون , غاز الهيدروجينغاز الميثان بخار الماء ...(نسبة مهملة من غاز الأكسجين )
غاز الأكسجين بدأ في الظهور منذ 2 مليار سنة و بعد 500 مليون سنة وصلت نسبته 3% و يعزى تشكله الى الطحالب البحرية التي استطاعت تثبيت غاز الآزوت و طرح غاز الأكسجين
3- تركيب الغلاف الجوي :
يتألف الغلاف الجوي من عدة غازات :
- غاز الآزوت بنسمة حجمية 78,1%
- غاز الأكسجين بنسبة حجمية 20,9%
- غاز الأرغون بنسبة حجمية 0,9%
- الغازات المتبقية تمثل نسبة 0,1%
بالاضافةالى بخار الماء الذي تتغير نسبته من مكان لآخر .
4- طبقات الغلاف الجوي :
الغلاف الجوي الارضي يمثل طبقة غازية سمكها في حدود 10000Km و تتناقص كثافته كلما زاد الارتفاع عن السطح الارض ( 99% كم كتلة الهواء تركز في 30 Km الاولى )
الغلاف الجوي الارضي يتألف من عدة طبقات
1- التبوسفير Tropohsphre و هي الطبقة القريبة من سطح الأرض (11-16Km)
- تحدث فيها النشاطات المناخية ( السحب , الرياح )
تنخفض درجة الحرارة بمعدل 6,5° C كلما ارتفعنا 1Km
2- الستراتوسفير (Stratosphère (1-50Km تضم طبقة الاوزون التي تحمي سطح الارض من الاشعة فوق البنفسجية و المحصورة بين 20-30Km
3- الميزوسفير (Mésosphère (50- 80Km في هذه الطبقة تحترق الشهب تصل فيها درجة الحرارة الى أقل من -110ّ°C
4- الترموسفير (Thermosphère (80-600 Km الهواء فيها نادر تصل درجة حرارته 1200°C تعكس أمواج الراديو التي تثيت من المحطات الارضية
5- الإكزوسفير ,Exosphère تمتد الى 10000Km الهواء فيها جد نادر تدور فيها الاقمار الاصطناعية
الدورة الطبيعية للماء
وضعية - اشكالية
هل كمية الماء في الطبيعة ثابتة ؟
- الحركة مستمرة للماء بين الارض و الغلاف الجوي تسمى دورة الماء في الطبيعة
- الماء يسري بصفة دائمة في الغلاف الجوي على سطح الارض و تحت سطح الارض تحت تأثير حرارة الشمس فإن مياه البحار الأنهار و البحيرات تسخن فتتخبر متحولة الى بخار الماء الذي يشكل السحب هذه الاخيرة تدفعها الرياح و عندما تعبر المناطق الباردة فإن بخار الماء يتكثف ليعود اقطا على سح الارض على شكل مطر أو ثلج أو برد
عندما يصل ماء المطر الى سطح الارض فإنه :
إما أن يتبخر من جديد الى الغلاف الجوي
أو يسري على سطح الأرض مغذيا المجاري الأنهار و الادوية التي تعيد جزء منه الى البحار
أو ينفذ تحت سطح الأرض مغذيا الطبقات المائية في باطن الارض و الذي يعود جزء منه الى سطح الأرض بعدة طرق
اذن يمكن تقسيم دورة الماء الى عدة مراحل :
التبخر : évaporation
التكاثف : condensation
التساقط : pécipitation
السيلان : ruissellement
النفوذ: infiltration
طريقة الكشف عن الماء
وضعية - اشكالية
الماء يوجد في الطبيعة بشكل مستقل كما يعتبر من المكونات الاساسيةلكثير من الاجسام حيث يكون ممزوجا بمواد أخرى و بالتالي تمييزه عن المواد الاخرى مباشرة بالعين المجردة أمر غير ممكن
اقترح طريقة عملية الكشف عن الماء في مختلف الأجسام محددا الوسائل اللازمة لذلك
تجربة 1: تحصسر الكاشف :
أ - الوسائل :
1- مصبتج بنزن
2- جفنة
3- مخلاط (قضيب زجاجي )
4- كبريتات النحاس المائية
الشكل (1)
ب- الخطةات العملية :
نضع كمية من كبريتات النحاس المائية ذات اللون الازرق في جفنه
نيحتها مع التحريك بالقضيب الزجاجي
المشاهدة :
تلون كبريتات النحاس الابيض التي تسمى عندئذ كبريتات النحا اللامائية ( الجافة )
الشكل (2)
ملاحظة : عند التسخين في انبوب اختبار نشاهد قطرات من الماء على الجدران الداخلية عند بداية التسخين
تجربة 2: اختبلر الكاشف :
نضع قطرة من الماء فوق كومة من كبريتات النحاس اللامائية
المشاهدة :
تغير لون كبريتات النحاس من الابيض الى الازرق
الشكل (3)
استنتاج : يمكن الكشف عن الماء بكبريتات النحاس اللامائية
تجرية 3: الكشف عن الماء في بعض السوائل:
نضع قطرة من كل سائل على كومة من كبريتات التحاس اللامائية
الشكل (4)
المشاهدة و الاستنتاج :
| هل السائل يحتوي على ماء ؟ | لون كبريتات النعاس اللامائية | السائل |
| نعم | أزرق | الحليب |
| لا | ابيض | زيت عباد الشمس |
| نعم | ازرق | عصير البرتقال |
| لا | ابيض | عطر |
تجربة 4: الكشف عن الماء في بعض المواد الصلبة:
1- نضع كمية من كبريتات النحاس الجافة فوق قطعة خيز ثم نقوم بتسخينها
2- نضع كمية من كبريتات النخاس الجافة فوق قطعة من حبة بطاكا
3- نمزج كمية من السكر مع كمية من كبريتات النحاس الجافة
4- نضع كمية من كبريتات النحاس الجافة قوق نصف تفاحة
المشاهدة و الاستنتاج :
| هل السائل يحتوي على ماء ؟ | لون كبريتات النحاس اللامائية | المادة |
| نعم | أزرق | قطعة حبز |
| نعم | أزرق | حبة بطاطا |
| لا | أبيض | سكر |
| نعم | ازرق | تفاح |
مدخل في الكيمياء العضوية
المركبات العضوية هي مركبات مصدرها نباتي أو حيواني , و يمكن اصطناعها عن طريق التركيب الكيميائي
- أهم مصدر للمركبات العضوية الصناعية هو البترول و مشتقاته
- المركبات العضوية هي أنواع كيميائية تتألف جزيئاتها أساسا من عنصرالكربون C و الهيدروجين H و الأكسجين O , بالإضافة الى عناصر أخرى مثل الأزوت N , الكبريت S, الكلور Cl , الصوديوم Na,......الخ
- التحليل الكيفي العنصري يمكن من الكشف عن العناصر الكيميائية المؤلفة لمركب عضوي
- تكشف عن عنصر الفحم من أو
أو
- نكتشف عن عنصر الهيدروجين من
الفحوم الهيدروجينية
الفحوم الهيدروجينية مركبات عضوية على عنصري الفحم C و الهيدروجين H فقط
صيغتها العامة هي :
أهم مصدر للفحوم الهيدروجينية هو البترول و الغاز الطبيعي , يمكن فصل مكونات البترول بعملية التقطير المجزأ . الذي يعتمد على اختلاف درجة حرارة غليان مكوناته .
- تصنف الفحوم الهيدروجينية الى عائلات منها :
- الألكانات : و هي فحوم هيدروجينية مشبعة (تتضمن روابط تكافئية لسيطة ) صيغتها العامة : منها الميثان , الإيثان , البروبان ......الخ
-الألكانات : و هي فحوم هيدروجينية غير مشبعة (تحتوي على الأقل على رابطة ثنائية ) صيغتها العامة : منها : الإيثن , البروبن , البوتن .......الخ
الألكينات : و هي فحوم هيدروجينية غير مشبعة (تحتوي على الأقل على رابطة تكافئية ثلاثية ) صيغتها العامة مثل الإيثين , البروبين , البوتين .....الخ
- الفحوم الهيدروجينية الحلقية : و هي فحوم هيدروجينية غير مشبعة , تتميز بوجود حلقة بنزنية مثل البنزن
- تتفاعل الفحوم الهيدروجينية مع ثنائي الأكسجين على شكل :
- احتراق تام : ينتج عنه ثنائي أكسيد الكربون و الماء
- احتراق غير تام : و ينتج عنه الفحم C و أحادي أكسيد الكربون CO و الماء
- ينتج من تفال الاحتراق حرارة فنقول عنه تفاعل كيميائي ناشر للحرارة .
الفصل اللوني - الكروماتوغرافيا
التقطير المائي : طريقة لاستخلاص المركبات العضوية من مصدرها الطبيعية (النباتات ) . تعتمد على سحب المادة المراد استحلاصها بواسطة بخار الماء و بعد تكاثفها عن طريق التبريد نحصل على القارة
- الاستخلاص بالانحلال : طريقة تعتمد على إذابة المركب في مذيب عضوي مناسب لا يتمازح مع الماء , ثم يفصل الور العضوي عن الطور المائي بعملية التركيد
- التركيب : هو تحول كيميائي نحصل منه على مركب كيميائي اعتبارا منالعناصر الكيميائية المؤلفة له أو من مركبات أبسط منه ( المادة الأولية أو الخام )
- في الصناعة و في المخبر يمكن تركيب كثير من المركبات العضوية الموجودة في الطبيعة أو اصطناع مركبات لا توجد أصلا في الطبيعة
- يستفاد من التركيب لإنتاج جزيئات جديدة . الشروط التجريبيو كدرجة الحرارة و نسب النتفاعلات و الوسيط مهمة في التركيب الكيميائي .
- لا يوجد فرق بين جزيئات المركب الطبيعي و الاصطناعي الذي يؤكب في المخبر أو الصناعة
- الفصل اللوني (الكروماتوغرافيا ): تقنية مخبرية لفصل الأنواع الكيميائية الموجودة في خليط سائل و الكشف عنها .
- تعتمد على هجرة الأنواع الكيميائية بالنسبة لطور ثابت , و سرعة انتشارها المختلفة التي تتعلق بطبيعتها و بطبيعة المذيب فقط . و بطبيعة المذيب فقط . نتعرف على النوع الكيميائي بمقارنة نسبته الجبهية مع نسب أنواع كيميائية مرجعية معروفة .
النسبة الجبهية : هي النسبة بين المسافة التي قطعها النوع الكيميائي الى المسافة التي قطعها المذيب :
في نفس الشروط التجريبية يكون لنوعين كيميائيين نفس النسبة الجبهية