ملخص الدرس / الأولى ثانوي/فيزياء/الانسان و البيئة / الماء في الطبيعة
دورة الماء في طبيعة
ان الحركة الدؤوبة للماء في الطبيعة بين مصادر الماء على الارض ومن تحتها والغلاف الجوي ثم عودتها الى الارض مرورا بمراحل التكاثف , التساقط , السيول والتبخر والنتح تشكل دورة كاملة للماء
حرارة الشمس تغذي هذه الدورة التي تتدخل فيها أيضا جاذبية الأرض
التبخر
يسخن الماء السطحي (للبحر و المسطحات المائية ) بفعل حرارة الشمس , و عندما تختزن جزيئات الماء طاقة كافية تتحول الى بخار , يصعد الى الأعلى ( وهو غاز عديم اللون )
النتح
ويخص النبات الذي يكسو الكرة الأرضية (الغطاء النباتي ) فأوراق الأشجار و النباتات بصفة عامة تطرح هي أيضا الماء بشكل بخار (ظاهرة النتح) فيمكن لشجرة عادية في حالة نمو أن تطرح من 5 الى 10 مرات
حجم الماء الذي تحتويه يوميا
التكاثف
عند صعود بخار الماء يبرد و يتكاثف في شكل قطرات حول الدقائق العالقة العالقة بالجو , و يتحول الى حالة سائلة , ان قطرات الماء تتجمع لتشكل ركاما من السحب
التساقط
تنتقل السحب بفعل الرياح و عندما تتشبع السحب بقطرات الماء, تتساقط على شكل مطر بفعل جاذبية الأرض و حسب درجة الحرارة يمكن أن تسقط على شكل ثلج أو برد أو مطر
السيول
الماء المتساقط على شكل أمطار أو الناتج عن ذوبان الثلوج و الجليد يسيل على سطح الأرض فيزداد مخزون الماء في الأحواض المائية و يتدفق ليشكل روافد المياه الجارية ( لأنهار و الوديان)
التسرب
جزء من الماء المتساقط ينفذ داخل الأرض عبر شقوق و مسامات التربة و الصخور و يستقر في تجويفات الأرض الباطنية ليشكل بذلك المياه الجوفية و منها ما يخرج على شكل ينابيع
الابانة و الترشيح

الابانة و الترشيح عمليتان فيزيائيتان يتحول فيهما المحلول من خليط غير متجانس الى خليط متجانس
- الابانة : هي عملية تركيد الماء العكر ( أو المحلول بشكل خليط غير متجانس ) يحدث خلالها ترسيب المواد الثقيلة الى قعر الاناء بفعل الثقالة , الماء المتحصل عليه في النهاية عبارة عن محلول رائق أكثر شفافية مما
كان عليه
و الابانة عملية طبيعية تفصل فيها كثير من الأجسام التي تسبب تعكر المحلول و تحتاج الى وقت
- الترشيح : هي تقنية تسمح بفصل الجسيمات العالقة بالماء بواسطة جسم مرشح (ورق , رمل , فحم ) و السائل الناتج هو ّ الرشاحة ّ و يكون شفافا و هو الماء الصافي
- الماء الصافي : هو ماء مازال يحتفظ ببعض الأجسام المنحلة فيه و هو خليط متجانس
- يمكن فصل بعض الأجسام الأكثر صغرا و التي تبقى موجودة بالماء الصافي عن طريق تقنيات اضافية تستخدم فيها مواد مثل الفحم النشط أو مادة صمغية , حيث تحتجز أجساما في حالة غازية أو سائلة
الماء الصالح للشرب
أهم العمليات في معالجة الماء هي :
- الغربلة بالشبكة
- الطفو
- الابانة و الترشيح
- طرق فيزيائية - كيميائية
- طرق كيميائية
- طرق بيولوجية
معايير صلاحية الماء الشروب :
ان الماء المخزن و المحفوظ يمثل مصدرا أوليا للماء الصالح للشرب و لا يستهلك مباشرة الا بعد تحويله الى ماء شروب
المصالح العمومية تسهر على شروبية هذا الماء و تضع لذلك جملة من المعايير أهمها :
- معايير خاصة باللون و الرائحة و الطعم و الشفافية
- معايير خاصة بالأجسام غير المرغوب فيها مثل الفلور , النترات ,.... و التي يجب ألا تتجاوز حدا معينا مسموحا به
- معايير خاصة بالمواد السامة و التي تتطلب تحليلا معمقا لأن المقادير المسموح بها صغيرة جدا ( مثل الرصاص, الزئبق, الزرنيخ ,....)
- معايير ميكروبيولوجية : و تخص وجود ميكروبات مسببة للأمراض المتعددة المتنقلة بالماء
- معايير خاصة بالمبيدات : تخص وجود المواد الكيميائية المستعملة كمبيدات في الفلاحة ذ
- معايير خاصة بالمياه المحلاة ( الملطفة ) : و التي تؤدي الى تغيير تركيبة الماء من الأملاح المعدنية , حيث يجب أن تحتفظ بحد أدنى من الكالسيوم و المغنزيوم للمحافظة على التوازن الفيزيولوجي للانسان
- الماء الذي نطرحه بعد الاستعمال يجب أن يعالج هو بدوره , لكي لا يضر بالبيئة و يستفاد منه لأغراض أخرى (غير الشرب) كانتاج الأسمدة مثلا
النقاوة
النقاوة :
نقول في حياتنا اليومية عن الماء انه ّ نقيّ و يقصد به أنه ّ شروبّ مثل ماء الحنفية و الماء المعدني , التي توجد بها عدة أجسام (يشكل مجموعها خليطا متجانسا)
- النقاوة بمفهومها الكيميائي تعني وجود جسم واحد فقط أي نوع واحد من حبيبات المادة (جزيئات , ذرات ,...)
- الماء النقي : هو الماء الذي يتألف من نوع واحد من الجزيئات (هي جزيئات الماء ) التي صيغتها :
- التقطير : هي تقنية تستخدم للحصول على الماء النقي , يتم فيها تبخر الماء ( الخليط المتجانس) ثم تكثيف هذا البخار الى ماء سائل نقي , فالعملية هي فصل بقية المكونات الأخرى عنه , مثل الأجسام الصلبة التي
في الدورق و الغازات التي تنطلق و السوائل التي تتبخر
- الماء النقي :
- يتألف جزيء الماء من ذرتي هيدروجين و ذرة أكسجين واحدة
- صيغته الجزيئية :
- الحالة : يوجد في 3 حالات ( صلبة , سائلة , غازية )
- المظهر: عديم اللون و الرائحة و الطعم
- بعض خصائصه:
- محل (مذيب ) جيد لكثير من الأجسام الصلبة و السائلة و الغازية
- ناقل ضعيف للكهرباء
- الثوابت الفيزيائية :
- درجة التجمد : , درجة التبخر :
تحت الضغط الجوي النظامي (
جو =
)
- الكتلة الحجمية : أو
الماء في الأغذية
- يحصل الانسان على الماء عن طريق طعامه و شرابه
- يوجد الماء في كل الأغذية بنسب متفاوتة
- الماء المكون الأساسي للمواد الغذائية ذات المصدر النباتي و الحيواني , يدخل في اعداد المحاليل و المشروبات الغازية و العصير ,.... و أغلب المواد الاستهلاكية
- يحتوي الهواء على الماء و يشكل الرطوبة
- للكشف عن وجود الماء في المواد نستخدم من بين الكواشف بلورات كبريتات النحاس اللامائية ( بيضاء اللون ) التي تتحول الى اللون الأزرق بوجود الماء
- اعلم أن : ليست كل السوائل شفافة
الكشف عن الغازات في الماء

- الماء الطبيعي يحتوي على غازات منحلة فيه من بينها الهواء
- الهواء المنحل في مياه البحار و المستنقعات يساعد الكائنات الحية على العيش فيها
- تحتوي المياه المعدنية الغازية و المشروبات الغازية على غاز ثنائي أكسيد الفحم ( المعروف بغاز الفحم )
- يمكن الكشف عن غاز ثنائي أكسيد الفحم باستعمال رائق الكلس , حيث يعطي معه راسبا هو كربونات الكالسيوم , فنقول أنه يعكر رائق الكلس
بطاقة تعريف ثنائي أكسيد الفحم :
- الاسم : ثنائي أكسيد الفحم
- الصيغة :
- المظهر : غاز عديم اللون و الرائحة
- الكشف عليه : يعكر رائق الكلس
- حالته : غازي في الشروط العادية للحرارة و الضغط , و يوجد بحالة ثلج تحت ضغط عال ( يستعمل لاطفاء اللهب )
- يوجد في الهواء بنسبة قليلة
- ينحل في الماء
- ضروري للتمثيل الضوئي للنباتات
- ينتج من الاحتراق التام للمحروقات
- مسبب رئيسي لظاهرة الاحتباس الحراري
- غير سام لكنه خانق
المحلول المائي
- المحلول المائي هو ناتج انحلال الأجسام الشاردية و بعض الأجسام الجزيئية في الماء
- ابلمحلول الجزيئي هو المحلول الذي يتألف من جزيئات فقط , و هو لا ينقل التيار الكهربائي
- المحلول الشاردي هو المحلول الذي يحتوي على شوارد بالاضافة الى جزيئات الماء و ينقل التيار الكهربائي
عند انحلال مركب شاردي في الماء يحدث له تفكك و يصير محاطا بجزيئات الماء فنقول أن هذه الشوارد مميهة aqueuse , مثال : شوارد كلورالصوديوم في الماء يرمز لها ب : و
, حيث
يعني الرمزaq ّ مميهة ّ
هناك نوعان من الشوارد : الشوارد الموجبة و تدعى بالهابطات , و الشوارد السالبة و تدعى بالصاعدات
- أمثلة عن بعض الهابطات و الضاعدات :
| الصاعدات ( الشوارد السالبة ) ANIONS |
الهابطات ( الشوارد الموجبة ) CATIONS |
| الكلور |
الصوديوم |
| البروم |
البوتاسيوم |
| الفلور |
الفضة |
| الكبريت |
الكالسيوم |
| الأكسجين |
الباريوم |
| الكبريتات |
النحاس الثنائي |
| الكربونات |
الحديد الثنائي |
| النترات |
الحديد الثلاثي |
| الهيدروجينوكربونات |
المغنزيوم |
| الهيبوكلوريت |
المنغنيز |
| الكلورات |
الزئبق |
| البيكرومات |
الرصاص |
| الأكسلات |
الزنك |
| البرمنغانات |
الألمنيوم |
| الذهب |
|
| الهيدرونيوم |
|
| الأمونيوم |
مبدأ انحفاظ الشحنة يتحقق في المركب الشاردي , بحيث يكون :
مجموع الشحنات الموجبة يساوي مجموع الشحنات السالبة
- مثال : في كلور الصوديوم , لدينا لها شحنة عنصرية واحدة موجبة و شاردة الكلور
لها شحنة عنصرية واحدة سالبة , فيكون المجموع معدوما ( الاعتدال الكهربائي )
عند انحلال هذا الملح في الماء يبقى هذا المبدأ محققا
- باستخدام مبدأ انحفاظ الشحنة يمكن كتابة الصيغة الشاردية لمركب كيميائي مثلا : كبريتات الصوديوم تتشكل من شوارد الكبريتات و شوارد الصوديوم
أي
و صيغته :
الكشف عن الشوارد في المحاليل المائية
- باستعمال محاليل كاشفة يمكن أن نتعرف على بعض الشوارد في المحاليل المائية , فهي تتفاعل مع الكاشف و تعطي معه راسبا مميزا بلونه و مظهره
- يوجد في المياه الطبيعية شوارد عديدة مثل المغنزيوم و شاردة الكالسيوم
و شاردة الكبريتات
شاردة الكلور
يمكن الكشف عن بعض هذه الشوارد بترسيبها , فمثلا :
- نرسب شاردة الكلور بمحلول نترات الفضة , حيث ينتج راسب أبيض اللون هو كلور الفضة
- نرسب شاردة الكبريتات بمحلول كلور الباريوم , حيث ينتج راسب أبيض اللون هو كبريتات الباريوم
- نرسب شاردة الكالسيوم بمحلول أكسلات الأمنيوم , حيث ينتج راسب أبيض اللون هو أكسلات الكالسيوم
- ان تركيب الماء المعدني من المكونات الشاردية ثابت و تحدده قصاصة التعريف , و هذه الشوارد تعطيه الميزات الخاصة بالطعم و الاستخدام العلاجي
- ان قصاصة تعريف الماء المعدني تعطي دلالة على خاصية استهلاكه حسب الحاجة الوقائية أو العلاجية
- نميز المياه المعدنية , حسب تركيبها الى :
- مياه كبريتية كلسية
- مياه بيكربوناتية صودية
- مياه كلورية صودية
الترسبات الكلسية
الماء العسر و الماء اليسر :
ان عسر الماء يتعلق بتركيز شوارد الكالسيوم و شوارد البمغنزيوم
( هناك شوارد أخرى تتدخل بدرجة أقل نظرا لقلتها) نقول عن الماء قليل العسر أنه ماء يسر ( ماء عذب )
- ان الرغوة الصابونية التي يعطيها الماء تتعلق بعسره , فكلما كان الماء عسرا كلما صعب استخدامه في الغسيل , الماء اليسر أو العذب يعطي رغوة زائدة مع الصابون
- الدرجة الهيدروتيمترية : يعبر عن درجة عسر الماء بكمية كربونات الكالسيوم ( الكلس أو محلوله
و يرتبط هذا التركيز بدرجة عسر الماء و تدعى ب ّ الدرجة
الهيدروتيمترية ّ
- تستعمل سلاليم عديدة لقياس الدرجة الهيدروتيمترية
السلم المعتمد في منطقة البحر المتوسط تستعمل فيه الدرجة الهيدروتيمترية الفرنسية و رمزها
- حيث أن الدرجة الهيدروتيمترية تكافئ من
أو
من شوارد
الدرجة الهيدروتيمترية و عسر الماء ( جدول توضيحي )
| صفة الماء | العسر ب |
درجة العسر ب |
| ماء عذب جدا | |
|
| ماء عذب | |
|
| ماء متوسط العذوبة | |
|
| ماء عسر | |
|
| ماء شديد العسر | أكبر من |
أكبر من |
تصنيف المحاليل
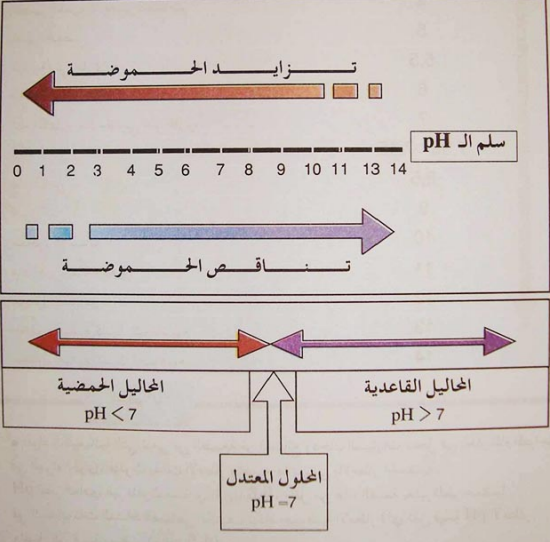
تصنف المحاليل المائية الى :
- محاليل حمضية , و لها
- محاليل معتدلة , و لها
- محاليل قاعدية , و لها
- يمكن معرفة حمضية المحلول أو قاعديته اما باستخدام الكواشف الملونة , مثل أزرق البروتيمول أو ورق
- يقاس مباشرة المحاليل في المخابر بجهاز أكثر دقة , يدعى جهاز ّ
- مترّ
قيم بعض المواد :
| |
المادة | ||
|
حمضية |
|
حمض كلور الماء المركز | |
| |
العصارة المعدية ( الهضمية ) | ||
| |
عصير الليمون | ||
| |
مشروب غازي | ||
| |
الخل | ||
| |
عصير العنب - عصير الطماطم | ||
| |
المطر الحمضي | ||
| |
ماء معدني غازي | ||
| |
الحليب | ||
| معتدلة | |
الماء المقطر -ماء معدني غير غازي | |
|
محاليل
قاعدية |
|
الدم | |
| |
ماء البحر | ||
| |
البوراكس | ||
| |
معجون الأسنان | ||
| |
ماء الجير - ماء جافيل | ||
| |
محلول النشادر | ||
| |
محلول هيدروكسيد البوتاسيوم | ||
| |
محلول هيدروكسيد الصوديوم |
- المواد الكيميائية التي ترمى في الطبيعة من المصانع و دخان السيارات تنحل في بخار الماء المتواجد في الهواء الجوي , فتلوث بذلك الأمطار و تصبح ما يسمى بالأمطار الحمضية
المطر العادي غير الملوث يساوي تقريبا
و أقل من هذه القيمة يعتبر المطر حمضيا
في البلدان ذات النشاط الصناعي الكثيف تزداد حموضية الأمطار ( أي تقل قيمة الأمطار و تصل الى قيمة وسطى تساوي
)
ان لهذه الأمطار الحمضية أضرار بالغة على المحيط و خاصة الغطاء النباتي مثل الغابات , و التربة الزراعية