ملخص الدرس / الثالثة ثانوي/فيزياء/الفصل الثاني/مراقبة تطور جملة كيميائية
الملخص
من الأستاذ(ة) fergani faresجهة التطور التلقائي لجملة كيميائية
1) التطور التلقائي لجملة كيميائية:
1 - 1) جهة التطور التلقائي لجملة كيميائية:
1 - 1 - 1) التحولات حمض - أساس:
نأخذ ثلاثة بياشر و
نضع بها محاليل تراكيزها
، بعد الرج والإستقرار نحصل على النتائج الموضحة في الجدول الموالي بحيث معادلة التفاعل:
ثابت التوازن : .
بحيث :
|
Ka |
C |
B |
A |
البيشر |
|
|
10 |
20 |
10 |
V1(CH3COOH) |
|
|
1 |
1 |
10 |
V2 (CH3COONa) |
|
|
1 |
5 |
10 |
V3 (HCOOH) |
|
|
1 |
10 |
10 |
V4 (HCOONa) |
|
|
3,8 |
3,7 |
4.2 |
PH |
البيشر :
لدراسة جهة تطور التفاعل هناك عدة طرق حسابية منها:
أ) دراسة النسبة : مثلا:
- لما :
ولدينا:
،
ومنه
نجد :
.
- عند نهاية التفاعل : و
نجد:
.
نلاحظ أن: تطور الجملة يكون في الإتجاه المباشر
: (إختفاء
وتشكل الشوارد
).
ب) دراسة كسر التفاعل :
- لما :
ج) عند نهاية التفاعل : نجد:
نلاحظ أن
تطور الجملة يكون في الإتجاه المباشر
: (إختفاء
وتشكل شوارد
).
بنفس الطريقة نحصل على نتائج البيشرين و
والموضحة في الجدول المقابل:
|
جهة التطور |
|
|
|
|
البيشر |
|
العكسي |
|
|
|
|
|
|
حالة توازن |
|
|
|
|
|
التحولات أكسدة وإرجاع
1 - 1 - 2) التحولات أكسدة وإرجاع:
نضع في أنبوب من محلول نترات الفضة تركيزه
ونغمس فيه سلكا من النحاس فنلاحظ تلون المحلول بالأزرق وترسب الفضة على السلك النحاسي.
معادلة التفاعل :
ثابت التوازن: لأن
نلاحظ أن
تطور الجملة يكون في الإتجاه المباشر
.
وفيما يلي تفاصيل اكثر في هذه الفيديوهات:
الفيديو الاول:
النتيجة
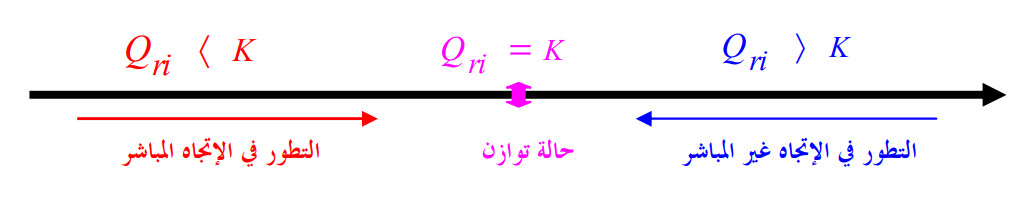
1 - 1 - 3) النتيجة:
نلخص النتائج السابقة في المخطط التالي (الشكل 01).
تطبيق على الأعمدة
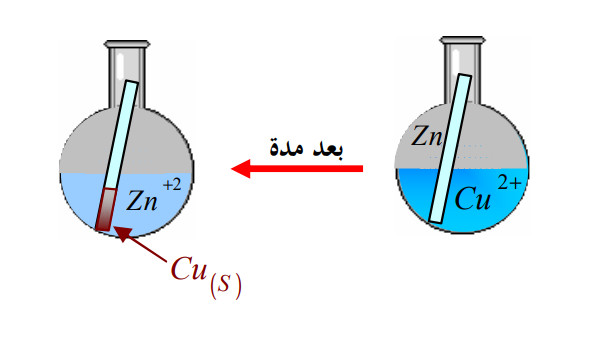
1 - 2) تطبيق على الأعمدة:
1 - 2 - 1) التحول الكيميائي التلقائي بتحويل إلكتروني مباشر:
تجربة:
نضع في بيشر محلولا لكبريتات النحاس ، ثم نغمس فيه صفيحة من معدن الزنك
(الشكل 01).
- نلاحظ زوال اللون الأزرق تدريجيا مع تشكل راسب أحمر من النحاس على صفيحة الزنك.
معادلات الأكسدة والإرجاع:
الثنائية
الثنائية
ثابت توازن التفاعل :
.
لدينا: لأن
نلاحظ أن :
وبذلك تتطور الجملة في الإتجاه المباشر.
- التحول الإلكتروني السابق يحدث بطريقة تلقائية (عفوية) ومباشرة بالتماس بين الذرات والشوارد
.
- هذا الإنتقال يمكن أن يتم بواسطة دارة خارجية، وبذلك سنحصل على عمود تتحول خلاله اشتغاله الطاقة الكيميائية المقرونة بالتفاعل إلى طاقة كهربائية.
التحول الكيميائي التلقائي بتحويل إلكتروني غير مباشر في عمود
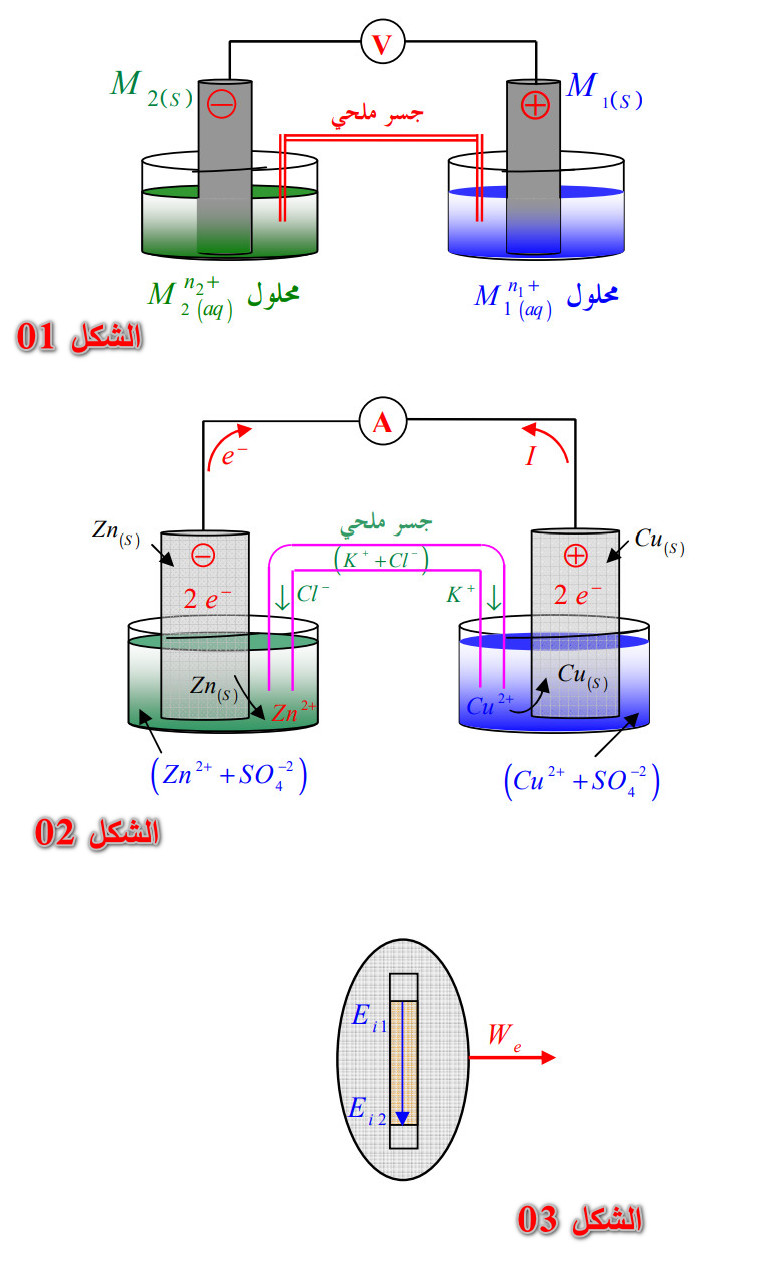
1 - 2 - 2) التحول الكيميائي التلقائي بتحويل إلكتروني غير مباشر في عمود:
أ) وصف عمود دانيال: يتكون من :
- النصف الأول : صفيحة لأحد المعادن مغمورة في محلول يحتوي على الشوارد
.
- النصف الثاني : صفيحة لأحد المعادن مغمورة في محلول يحتوي على الشوارد
، يدعى كل واحد منهما بالإلكترود.
- جسر التوصيل : إما أنبوب يحتوي على محلول شاردي أو ورق ترشيح مبلل بمحلول شاردي لأحد الأملاح أو غشاء مسامي يمكن من الإتصال الكهربائي بين نصفي العمود، ويسمح كذلك لشوارد المحلول الملحي بالتحرك من أجل ضمان التعادل الكهربائي للمحلولين.
* لاحظ الشكل (01).
ب) الرمز الإصطلاحي : يرمز له عموماً بـ:
: المصعد
: المهبط.
مثال :
ج) تطور الجملة الكيميائية في العمود خلال اشتغاله:
التحول الذي يحدث أثناء اشتغال العمود ينمذج بتفاعل ثابت توازنه ، بحيث كلما كان كسر التفاعل
كلما أنتج العمود تيارا كهربائيا وعندما تصل الجملة إلى حالة التوازن
تنعدم شدة التيار الكهربائي ليتوقف العمود عن الإشتغال.
- التفاعل هو تفاعل أكسدة وإرجاع بحيث :
... (المصعد) إرجاع.
... (المهبط) أكسدة.
مثال : في العمود
* لاحظ الشكل (02).
د) القوة المحركة الكهربائية لعمود :
تمثل فرق الكمون بين مسريي العمود (عندما لا يجري أي تيار)، يمكن الكشف عن قطبي العمود عمليا باستعمال جهاز الفولط - متر، بحيث تتأثر بدرجة الحرارة والتراكيز الموالية للمحاليل.
|
القوة المحركة |
العمود |
|
|
|
|
|
|
|
|
|
هـ) كمية الكهرباء التي ينتجها عمود خلال اشتغاله:
كمية الكهرباء المارة بين مربطي العمود خلال مدة زمنية هي:
، وبما أن حملة الشحنة هي الإلكترونات فهي تساوي
بحيث
: هو عدد الإلكترونات الذي يعبر مقطع الجسر خلال المدة الزمنية
.
وكمية مادة الإلكترونات الموجودة في العدد هي
.
وبالتالي : نضع
(شحنة مول من الإلكترونات).
: يسمى الفراداي وبذلك يعبر عن كمية الكهرباء الممرة كما يلي :
لدينا: ،
.
ومنه: .
وعند اشتغال العمود الكهربائي، يحدث تغير في الطاقة الداخلية للجملة بسبب التحول الكيميائي الذي يكون مصحوبا بتحويل حراري بحيث معادلة انحفاظ الطاقة :
.
* لاحظ الشكل (03).
إجبار جملة كيميائية على التطور
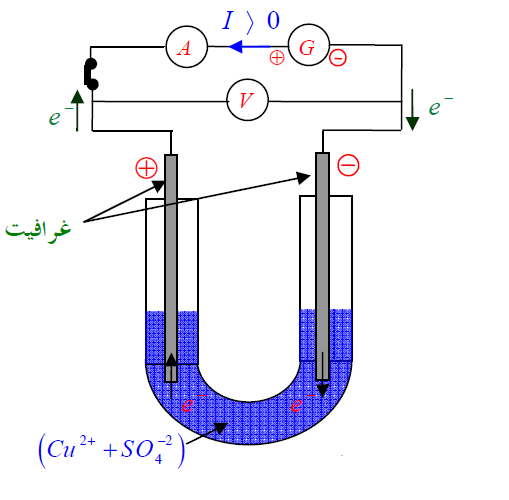
2) التحولات القسرية:
2 - 1) إجبار جملة كيميائية على التطور:
- في وعاء التحليل محلول كبريتات النحاس لا يشير جهاز الأمبير - متر بين مسرييه إلى مرور تيار كهربائي.
- عندما يوصل مولد كهربائي على التسلسل مع جهاز الأمبر - متر نلاحظ مرور تيار كهربائي دلالة على حدوث تحول كيميائي تظهر نتائجه في ترسيب النحاس عند المهبط وانطلاق غاز
عند المصعد.
- التيار الكهربائي المفروض على الجملة الكيميائية منطرف المولد أجبرها على التطور.
- التحول القسري لا يحدث تلقائيا وإنما يحدث بسبب طاقة مفروضة على الجملة من الوسط الخارجي.
التحليل الكهربائي لمتحلل كهربائي
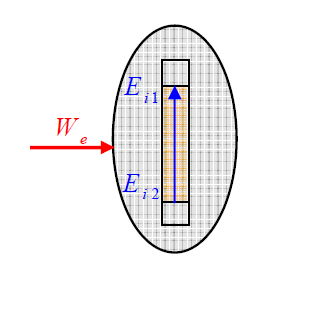
2 - 2) التحليل الكهربائي لمتحلل كهربائي:
نضع في وعاء تحليل محلولا محمضا لكلور القصدير نصل مسريي الغرافيت بمولد للتيار المستمر.
- بعد مدة نلاحظ تشكل شعيرات من القصدير عند المهبط و انطلاق غاز ثنائي الكلور
عند المصعد حدث تحول قرسي لمحلول كلور القصدير أي تحويل إلكتروني من شوارد
إلى شوارد
* معادلات التفاعل:
-المصعد : (أكسدة مصعدية):
- المهبط : (إرجاع مهبطي):
معادلة التفاعل المنمذج (التحليل الكهربائي):
* يمكن للمذيب أن يتدخل في عملية التحليل الكهربائي:
- المصعد :
- المهبط:
* يمكن كذلك أن يتدخل أحد المسربين (المصعد) في العملية (حالة المصعد المنحل).
مثال: التحليل الكهربائي المحلول كبريتات النحاس باستعمال مصعد من النحاس.
** (الأكسدة):
** (الإرجاع):
بالتالي يحدث تحويل لمعدن النحاس من المصعد إلى المهبط.
* كمية الكهرباء : أو
.
يأخذ : عدد الإلكترونات.
: تقدم التفاعل.
* الحصيلة الطاقوية:
نطبيق لأنواع التحليل الكهربائي
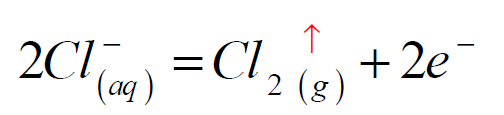
2 - 3) تطبيق لأنواع التحليل الكهربائي:
تظهر أهمية التحليل الكهربائي في الصناعة بواسطة:
* الإرجاع المهبطي : ترتكز عدة عمليات صناعية على إرجاع الشوارد المهبطية عند المهبط:
مثلا:
- ترسب طبقة معدنية على سطح جسم، طبقة فضية، طبقة ذهبية، طبقة كرومية، طبقة نحاسية ....إلخ.
- تنقية بعض المعادن من الشوارد.
* الأكسدة المصعدية : .
- تنقية بعض المعادن باستعمال مصعد منحل:
- تجميع غاز منطلق كإلنتاج غاز ثنائي الكلور مثلاً (الشكل 01).
أمثلة عن بعض التحولات الكيميائية التلقائية والقسرية
2 - 4) أمثلة عن بعض التحولات الكيميائية التلقائية والقسرية:
* المدخرة : عند شحن المدخرة بواسطة طاقة خارجية، يحدث للجملة تحول قسري ثم عند التفريغ يحدث تحول تلقائي، بحيث التحولان الحادثان متعاكسان أي التحول الحادث عند الشحن هو عكس التحول الحادث عند التفريغ.
* الخلية الحية: تخزن الطاقة في الخلية على شكل طاقة كيميائية، يلعب الـ: (أدينوزين ثلاثي الفوسفات) دون مخزن لهذه الطاقة، بحيث تستهلكه الخلية ثم تسترجعه بعد ذلك من أجل استمرارية حياتها.
- مرحلة الإستهلاك (تحول تلقائي): .
- مرحلة الإسترجاع (تحول قسري):
تحولات الأسترة وإماهة الأستر

3) مراقبة تحول كيميائي:
3 - 1) تحولات الأسترة وإماهة الأستر:
3 - 1 - 1) الأسترات العضوية:
هي مركبات عضوية يمكن اصطناعها من الكحولات والأحماض الكربوكسيلية:
- صيغتها الجزيئية نصف المفصلة (الشكل 01) صيغتها المجملة : بحيث
.
- تسميتها من الكحول (ول ويل)، من الحمض (ويك
وات).
أمثلة : (الشكل 02).
خصائص تحول الأسترة
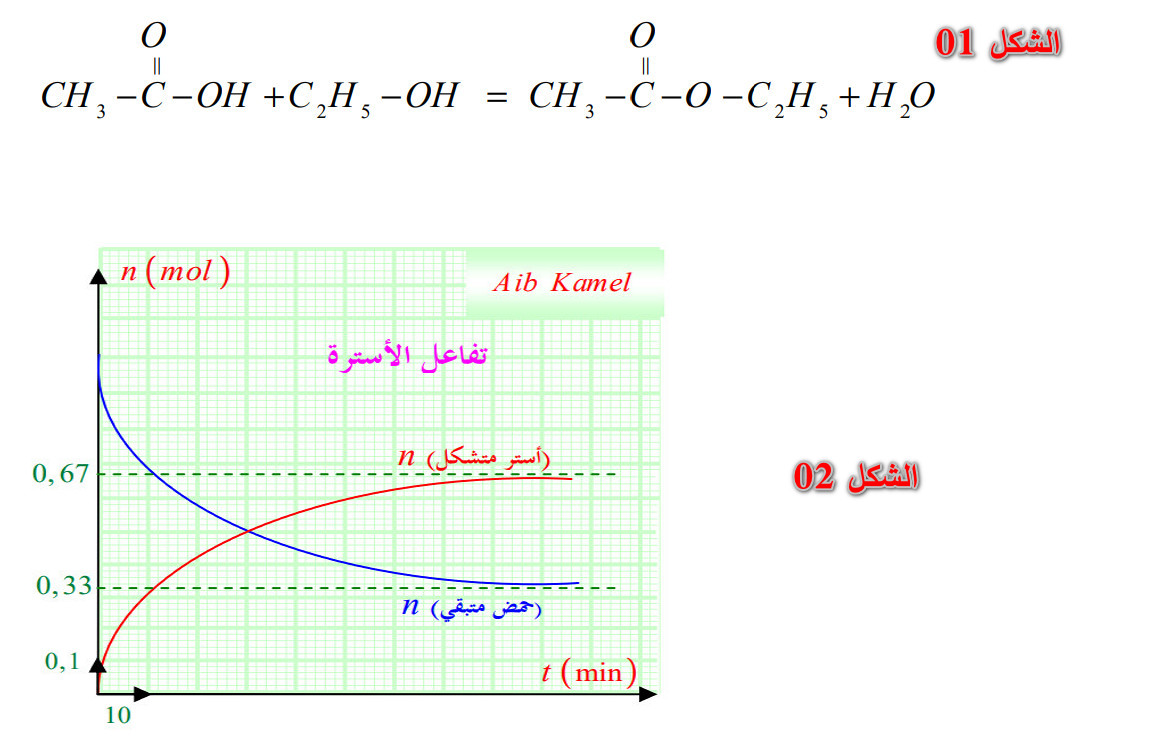
3 - 1 - 2) خصائص تحول الأسترة: ينتج الأستر من تفاعل حمض كربوكسيلي مع كحول حسب المعادلة التالية:
|
|
|
|||
|
الحالة الإبتدائية |
|
|
|
|
|
الحالة النهائية |
|
|
|
|
يأخذ الكمية الإبتدائية للمحض والكحول فيكون جدول التقدم:
- محدودية التفاعل : تفاعل الأسترة تفاعل غير تام (محدود)، بحيث وجدنا :
( أستر)
ثابت التوازن
- سرعة التفاعل : تحول الأسترة تحول بطيء.
- العامل الحراري للأسترة : نأخذ المثال التالي (الشكل 02 + الشكل 03).
- المركبة الحرارية للطاقة الداخلية للجملة الكيميائية الإبتدائية :
- المركبة الحرارية للطاقة الداخلية للجملة الكيميائية الإبتدائية:
نلاحظ أن :
ومنه طاقة التفاعل :
- نلخص خصائص تفاعل الأسترة في كلمة
* ملاعب : محدود - لا حراري - عكوس - بطيء.
تحولات الإماهة
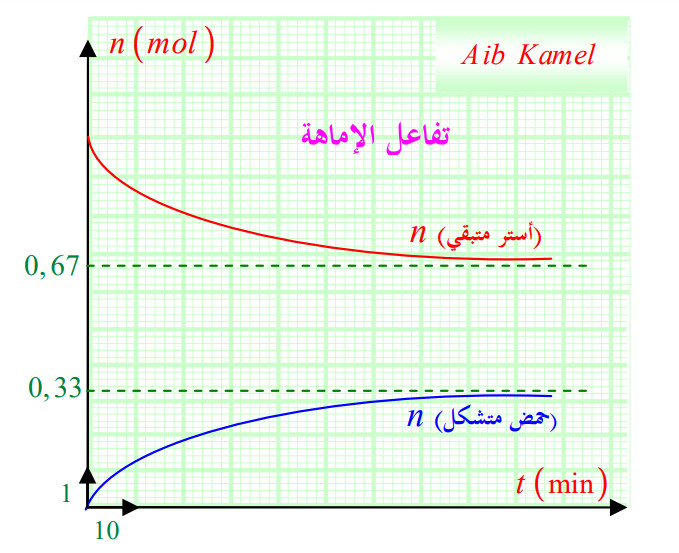
3 - 1 - 3) تحولات الإماهة:
وهو التفاعل العكسي للأسترة معادلته:
ثابت التوازن:
التوازن الكيميائي أسترة - إماهة الأستر
3 - 1 - 4) التوازن الكيميائي أسترة - إماهة الأستر:
نأخذ مثلا من الأستر و
من الماء أو العكس (تفاعل الأسترة) فنحصل على المحنى التالي:
* مردود التفاعل:
- تفاعل الأسترة:
- تفاعل الإماهة :
بحيث :
مراقبة النواتج
3 - 2) مراقبة تحول كيميائي:
3 - 2 - 1) مراقبة النواتج:
بمراعاة شروط إجراء التفاعلات واختيار الوسيط المناسب يوجه التحول الكيميائي إلى نواتج معينة مثل:
- نزع الهيدروجين من الكحول :
- نزع الماء من الكحول :
مراقبة السرعة
3 - 2 - 2) مراقبة السرعة :
سرعة التفاعل تتأثر بعدة عوامل حركية منها : درجة الحرارة، تراكيز المتفاعلات، الوسيط ...إلخ.
مراقبة المردود
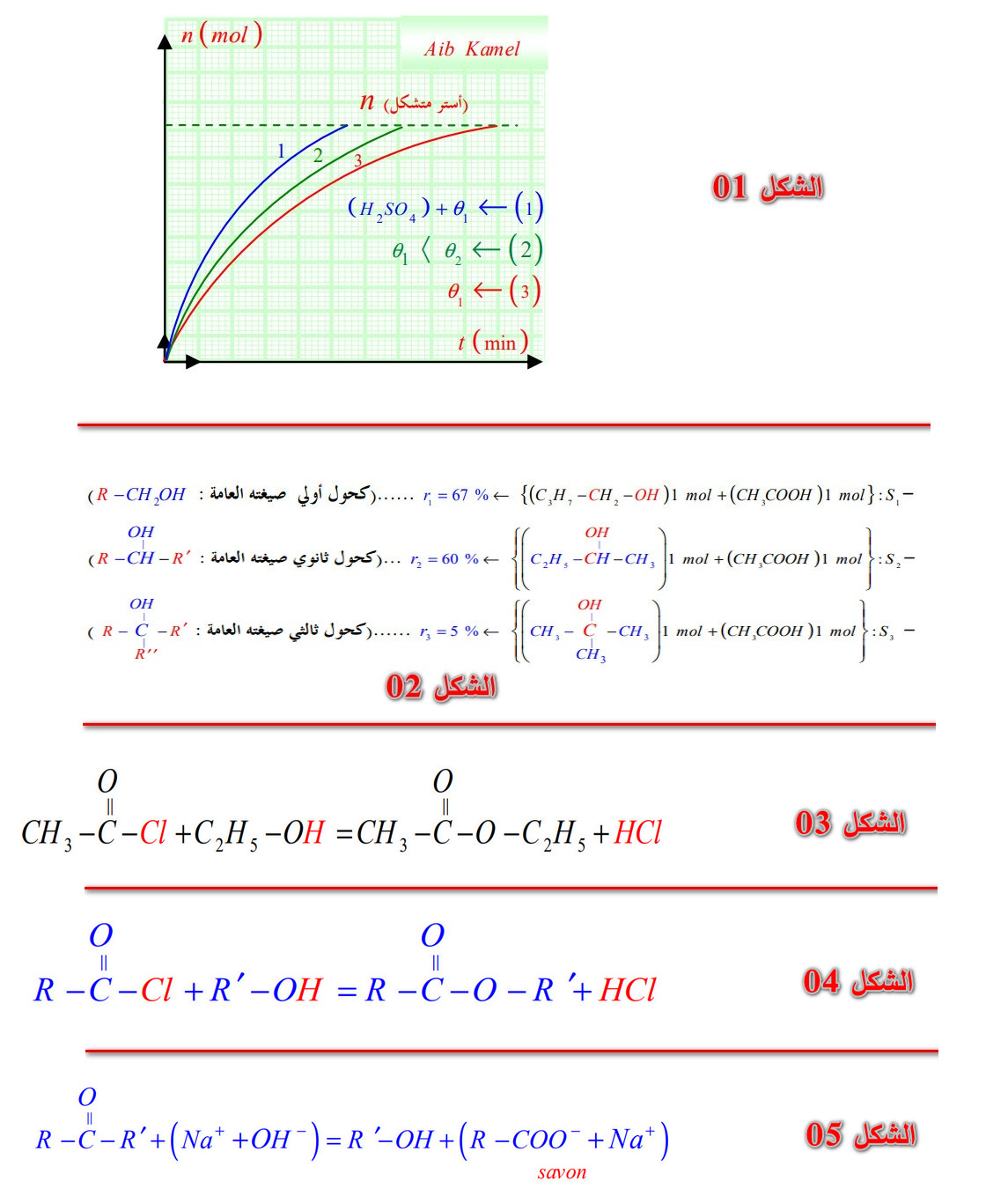
3 - 2 - 3) مراقبة المردود:
أ) باستعمال مزيج إبتدائي غير متكافئ: نحقق التجربتين التاليتين:
- وعاء :
.
- وعاء :
.
* نضيف بضع قطرات من حمض الكبريت المركز فنجد:
- الوعاء :
(أسترة)
.
- الوعاء :
(أسترة)
.
* يرتفع مردود تحول الأسترة أو تحول إماهة أستر عند استعمال مزيج غير متكافئ في كمية المادة (الشكل 01).
ب) إختيار صنف الكحول : نحضر ثلاث محاليل لتفاعل الأسترة فنجد مردود التفاعل :
* لاحظ الشكل (02).
* مردود تحول الأسترة يتعلق بصنف الكحول.
ج) إستعمال كحول الأستيل بدل الحمض الكربوكسيلي:
كلور الأسيل نوع كيميائي عضوي يشتق من حمض كربو كسيلي باستبدال بـ
مثال : كلور الميثانول ** كلور الإيثانول.
التسمية : حمض (ويك) كلور أسيل (ويل).
* تجربة : نضع من الإيثانول مع
من كلور الإيثانول فنحصل على نوع عضوي ذو رائحة الفاكهة (أستر) بوجود شروط معينة كتلته
.
* معادلة التفاعل (الشكل 03).
* مردود التحول : لدينا (كلور الأسيل)
،
(كحول)
.
* التحول تام وسريع
(أستر)
.
* عند استعمال كلور الأسيل بدل الحمض الكربوكسيلي يكون تحول الأسترة تاما وسريعا وناشراً للحرارة (الشكل 04).
تجربة : (حذف أحد النواتج) من أجل منع حدوث تفاعل إماهة الأستر في تحول الأسترة يجب.
- حذف الماء المتشكل باستعمال عملية التقطير مثلاً أو باستعمال نوع كيميائي يتفاعل مع الماء فقط مثل حمض الكبريت المركز.
- نزع الأستر عن طريق التقطير المجزأ أو بإضافة المركز فيكون التفاعل حسب المعادلة (الشكل 05).
تحولات الأسترة وإماهة الأستر
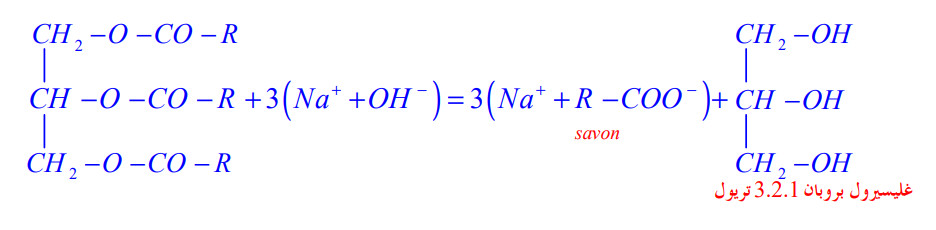
3 - 3) تحولات الأسترة وإماهة الأستر:
أ) صناعة الصابون:
نمزج كمية من زيت الزيتون مع بعض قطرات من المركز ثم نضيف إليه بضع مليمترات من الإيثانول و قليلا من الحجر الهش، نسخن المزيج لمدة
بالتقطير المرتد.
- نسكب الخليط في أرلينة ماير تحتوي على محلول مركز من كلور الصوديوم فنلاحظ ترسب الصابون حسب المعادلة (المعادلة 01).
ب) الوقود:
الأستر متواجد في زيت الكوزا ، وقابل للإستعمال كوقود للسيارات لأن خصائصه تماثل خصائص المازوت وأقل تلوثا (لا يحتوي على الكبريت).